重组漆酶降解黄曲霉毒素B1分子对接分析及产物结构解析(二)
酶魅力对AFs溶解率的危害:将酶魅力各自为1、2、3、4U和5U的漆酶各自与10μL0.1mg/mL的AFB1标液涡流震荡搅拌,30℃、200r/min孵育12h。对照实验为添加同样大小的pH5.7的0.1mol/L的PBS1别的情况同样。全部试验反复3次,溶解率按式(1)测算:
(8)AFs的获取
将孵育時间对AFs溶解率的危害:将酶魅力为3U的漆酶与10μL0.1mg/mL的AFB1标液涡流震荡搅拌,放置30℃、200r/min各自孵育12、24、36、48h和60h。对照实验为添加同样大小的pH5.7的0.1mol/L的硫酸铵缓存溶液(phosphatebuffersaline,PBS),别的情况同样。孵育溫度对AFs溶解率的危害:将酶魅力为3U的漆酶与10μL0.1mg/mL的AFB1标液涡流震荡搅拌,各自放置25、30、35、40℃和45℃气温下,200r/min孵育12h。对照实验为添加同样大小的pH5.7的0.1mol/L的PBS,别的情况同样。酶魅力对AFs溶解率的危害:将酶魅力各自为1、2、3、4U和5U的漆酶各自与10μL0.1mg/mL的AFB1标液涡流震荡搅拌,30℃、200r/min孵育12h。对照实验为添加同样大小的pH5.7的0.1mol/L的PBS1别的情况同样。解决的试品12000r/min离心式30s,使壁厚上的发酵物离心式至管底端,并转换至10mL的具塞玻璃试管中,向玻璃试管中添加等大小的三氯甲烷(在阴凉处开展),涡流震荡10min使其完全搅拌,随后倒进离心管架中,静放30min分层次,取顶层液态于玻璃试管中,添加等容积三氯甲烷,汲取下一层有机相发酵液于离心管架中,同样实际操作反复3次。合拼3次有机相于氮锅炉吹管中,于45℃N2烘干。再用甲醇溶液融解出AFs,并且用0.22μm滤纸过虑。
(9)HPLC-MS/MS检验AFs及标曲的制作
配置的内毒素标液和提炼的内毒素水溶液均用0.22μm滤纸过虑至高效液相瓶子中。
HPLC标准:高效液相控制模块为安捷伦1260Infinity:Inertsil0DS-3C18色谱柱(150mmX4.6mm,3μm);流动速度0.2mL/min;进样量5μL;流动性相A为0.1%苯甲酸水溶液,流动性相B为工业甲醇-水(3:7,V/V);剖析時间30min;检验溫度30℃。
MS/MS标准:电喷雾器离子源:检测方式:多反映检测;离子源溫度300℃:锥孔工作电压15psi;撞击工作电压135V;撞击动能30eV:毛细血管工作电压4kV;品质扫描仪范畴m/z313.0~285.0。
(10)响应面试验设计
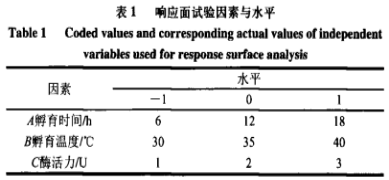
在单要素实验基本上,以孵育時间、孵育溫度和酶魅力做为调查要素,以AFB1溶解率是响应值,响应面试验设计要素与水准如表1所显示。
(11)AFB1溶解物质的测量及构造分析
HPLC标准:ZORBAX-SBC18色谱柱(100mmX2.1mm,3.5μm)。流动性相A为0.1%苯甲酸水溶液,流动性相B为0.1%苯甲酸–工业甲醇水溶液。梯度方向过柱程序流程:40%B,6min;60%B,保持16min;100%B,8min;一共运作30min。进样量5μL,流动速度0.4mL/min,柱温箱30℃。
MS标准:做雾化气GS1工作压力50psi;做雾化气GS2工作压力50psi;气帘气工作压力35psi;离子源溫度550℃:离子源,工作电压5500V;一级扫描仪去簇工作电压100V;对焦工作电压10V;品质扫描仪范畴m/z100~1500;二级扫描仪选用TOFMS-Productlon-IDA方式收集质谱分析数据信息,诱发撞击解离能量分別为20、40V和60V,气相前,用隔膜泵做品质轴校准,使品质轴偏差低于0.002%。
二、結果与剖析
1、漆酶的同宗模建結果
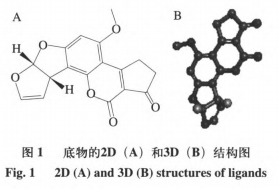
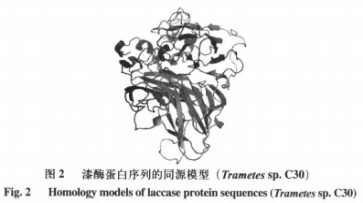
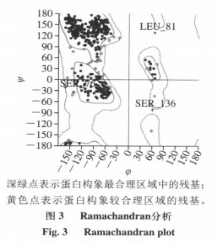
在本试验常用漆酶分子结构未被分析的情形下,运用一些已经知道漆酶分子结构的根基上同宗模建能够,较大的程度上获得理想的目地蛋白质三维构造。运用ChemBioDraw2014手机软件及其MOEv2014.0901手机软件制作并转化成三维构造,如图所示1所显示。科学研究AFs与该酶的融合方式第一步必须搭建同宗实体模型,結果如表2和图2所显示。图3剖析表明,99%的漆酶残基坐落于蛋白质构像的有效地区,这说明本试验搭建的漆酶同宗实体模型合乎立体化学标准,具备合理化。
2、漆酶与AFB1的相互影响剖析
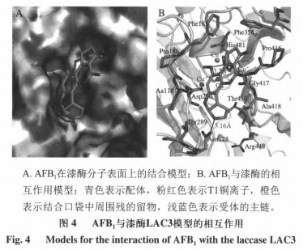
选用分子对接方式科学研究AFB1与栓菌漆酶表层的相互影响,致力于剖析AFB1与漆酶相互影响方式。为确立漆酶和内毒素的融合方式,选用诱发切合的对策,依据配位的构像主链蛋白激酶袋子容许挪动融入,将内毒素各自对收到漆酶的活性位置,获得漆酶魅力结构域与配位的融合方式,如图所示4所显示,连接打分成-6.4532kca/mol。
依据所建立的连接实体模型,如图所示4所显示,AFB1上叔丁基的氧分子可做为共价键的蛋白激酶,与漆酶上一个高宽比传统与此同时也挨近碘离子(T1CuI)部位的His481上碳水化合物主链产生共价键,此外,AFB1咪唑环上的氧分子还可以做为共价键的蛋白激酶,与漆酶Asn288的主链产生共价键,因而,His481和Asn288是漆酶和AFB1融合时的重要碳水化合物结构域,根据共价键相互影响。
酶-配位的融合感染力与其说相互影响的速率相关,遭受配位的结构类型和歪曲水平及其配位和酶表层中间样子相辅相成的危害。有研究表明共价键是酶与配位相互影响的重要相互作用力,参加共价键产生的氨基酸残基被觉得是漆酶与小分子水配位相互影响的重要残基。在其中氧分子与氨基酸残基产生的氢键作用强过氧原子与氨基酸残基产生的共价键,且共价键键长越少,功效越强。连接仿真模拟研究表明,存有于T1铜孤电子对层中的单纯的残基His481最很有可能与AFs产生相互影响,产生共价键,推断其能够受体空气氧化全过程中的电子转移,提升电子传递高效率,进而提升漆酶催化反应工作能力。综合性各个方面因素导致酶对内毒素的功能工作能力存有差别,主要表现为连接成绩不一样。
文章版权备注
- 2023-05-01奶味香精的制备技术与开发现状
- 2023-04-04阿魏酸及其衍生物在食品添加剂领域研究进展(一)
- 2023-03-23甘肃省榆中县市场监督管理局强化食品快检 筑牢食品安全防线
- 2023-03-23常德:专项整治酒类市场12种违法行为
- 2023-03-23贵州这7批次食品检出食品添加剂问题,有食用植物调和油、冰糖大蒜、无油剁椒等
- 2023-03-23怀化:部署开展制止餐饮浪费专项行动
- 2023-03-23超90%展商已确认展位 6月食品原料展带来海内外商机
- 2023-03-23关于召开2023年国际食品安全与健康大会的通知
- 2023-03-23河南省市场监管局召开落实食品安全“两个责任”暨制止餐饮浪费专项行动调度视频会议
- 2023-03-23邵阳市食品安全“两个责任”机制推进暨野生蘑菇中毒防控部署电视电话会议召开

 豫ICP备19024296号
豫ICP备19024296号 售前咨询
售前咨询